Médicaments
Protelos, Diamicron et Coversyl : des explications
12/09/11 10:49
Ces 3 médicaments sont efficaces, mais des décisions du laboratoire, avalisées par la HAS, me rendent perplexe.
Protelos (strontium)
Médicament efficace sur l'ostéoporose, agissant à la fois sur les ostéoblastes (+) et les ostéoclastes (-).
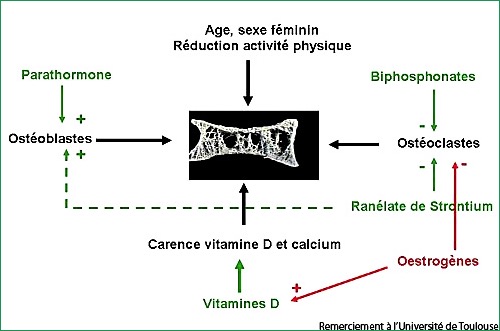
2 types d'effets indésirables majeurs ont été identifiés pour ce médicament :
- le risque thrombo-embolique veineux
- le risque allergique (DRESS syndrome ou Drug Rash with Eosinophilia and Systemic Syndrom).
Nous rappelons à chaque délivrance que le traitement doit être arrêté immédiatement et qu'il convient de contacter son médecin traitant en cas d'éruption cutanée.
Nous n'avons à ce jour aucune fréquence de survenue concernant le 1er risque, mais sommes tenus de demander aux patients de poursuivre leur traitement (avis du 09/09/2011).
Diamicron (gliclazide)
Médicament efficace sur le diabète, dont le dosage vient de passer de 30mg à 60mg pour un comprimé deux fois plus gros, mais heureusement sécable. (30 mg/jour suffisent pour beaucoup de patients).
Des laboratoires réputés ont investi et fabriquent des génériques dosés à 30mg. Concernant le dosage à 60mg, la commission de transparence évoque « un complément de gamme » qui n'apporte pas d'amélioration du service médical rendu.
En réalité, le dosage 30mg est supprimé à écoulement du stock, ce qui réduit à néant les investissements des concurrents, nos efforts de substitution et met en danger le stock actuel en génériques à 30mg de toutes les pharmacies.
Le dosage 60mg ne sera pas génériqué avant plusieurs mois… avant de passer en comprimés à 120mg quadrisécables?
Le dosage à 30mg étant encore sur le marché et dans toutes les armoires à pharmacie, c’est la confusion la plus totale sur le nombre de comprimés devant être pris chaque matin.
Ce risque a-t-il été évalué ?
Coversyl
Médicament efficace sur l’hypertension, les dosages à 2, 4 et 8mg ont été respectivement remplacés par des dosages à 2.5, 5 et 10 mg.
Il suffisait de changer de sel pour contrer les génériques :
Coversyl ancienne formule (celle des génériques) : Périndopril (368,4 g/mol) + Tertbutylamine (73,1 g/mol)
Coversyl nouvelle formule (sans générique) : Périndopril (368,4 g/mol) + Arginine (174,2 g/mol)
Le changement de sel n'apporte RIEN aux patients. Il serait utile pour améliorer la conservation des comprimés.
Ce qui est sûr, là encore, c'est qu'aucune possibilité de générique n'existe.
Les informations concernant les modifications de Diamicron et Coversyl ont été signées par des pharmaciens intérimaires. Tout le monde doit vivre, y compris de nombreux pharmaciens, mais ces décisions sont-elles bien raisonnables ?
Protelos (strontium)
Médicament efficace sur l'ostéoporose, agissant à la fois sur les ostéoblastes (+) et les ostéoclastes (-).

2 types d'effets indésirables majeurs ont été identifiés pour ce médicament :
- le risque thrombo-embolique veineux
- le risque allergique (DRESS syndrome ou Drug Rash with Eosinophilia and Systemic Syndrom).
Nous rappelons à chaque délivrance que le traitement doit être arrêté immédiatement et qu'il convient de contacter son médecin traitant en cas d'éruption cutanée.
Nous n'avons à ce jour aucune fréquence de survenue concernant le 1er risque, mais sommes tenus de demander aux patients de poursuivre leur traitement (avis du 09/09/2011).
Diamicron (gliclazide)
Médicament efficace sur le diabète, dont le dosage vient de passer de 30mg à 60mg pour un comprimé deux fois plus gros, mais heureusement sécable. (30 mg/jour suffisent pour beaucoup de patients).
Des laboratoires réputés ont investi et fabriquent des génériques dosés à 30mg. Concernant le dosage à 60mg, la commission de transparence évoque « un complément de gamme » qui n'apporte pas d'amélioration du service médical rendu.
En réalité, le dosage 30mg est supprimé à écoulement du stock, ce qui réduit à néant les investissements des concurrents, nos efforts de substitution et met en danger le stock actuel en génériques à 30mg de toutes les pharmacies.
Le dosage 60mg ne sera pas génériqué avant plusieurs mois… avant de passer en comprimés à 120mg quadrisécables?
Le dosage à 30mg étant encore sur le marché et dans toutes les armoires à pharmacie, c’est la confusion la plus totale sur le nombre de comprimés devant être pris chaque matin.
Ce risque a-t-il été évalué ?
Coversyl
Médicament efficace sur l’hypertension, les dosages à 2, 4 et 8mg ont été respectivement remplacés par des dosages à 2.5, 5 et 10 mg.
Il suffisait de changer de sel pour contrer les génériques :
Coversyl ancienne formule (celle des génériques) : Périndopril (368,4 g/mol) + Tertbutylamine (73,1 g/mol)
Coversyl nouvelle formule (sans générique) : Périndopril (368,4 g/mol) + Arginine (174,2 g/mol)
Le changement de sel n'apporte RIEN aux patients. Il serait utile pour améliorer la conservation des comprimés.
Ce qui est sûr, là encore, c'est qu'aucune possibilité de générique n'existe.
Les informations concernant les modifications de Diamicron et Coversyl ont été signées par des pharmaciens intérimaires. Tout le monde doit vivre, y compris de nombreux pharmaciens, mais ces décisions sont-elles bien raisonnables ?
Déclaration d'effets indésirables par les patients
16/06/11 06:58
Le décret 2011-655 et l'arrêté parus au Journal Officiel le 12 juin permettent à tous de déclarer les effets indésirables rencontrés avec les médicaments. Les documents sont à télécharger sur le site de l'Afssaps ou directement sur la page médicaments de ce site.
Nous continuons à déclarer tout nouvel effet indésirable au centre de pharmacovigilance de Nancy (2 signalements cette semaine) mais sommes aussi à votre disposition pour vous aider à remplir ou transmettre vos déclarations.
Nous continuons à déclarer tout nouvel effet indésirable au centre de pharmacovigilance de Nancy (2 signalements cette semaine) mais sommes aussi à votre disposition pour vous aider à remplir ou transmettre vos déclarations.
Médicaments et parabènes
25/05/11 07:58
Une liste de médicaments contenant des parabènes a été publiée. Elle ne présente AUCUN intérêt puisqu'elle ne précise pas le type de parabène, sa concentration, sa durée d'exposition et sa voie d'administration.
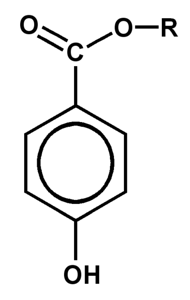
Les parabènes (paraoxybenzoates) sont des esters d'acide p-hydroxybenzoïque.
Ils sont utilisés comme conservateurs dans l'alimentation, dans les cosmétiques et les médicaments (349 spécialités, source Clickadoc de mai 2011). Historiquement, ils ont remplacé avantageusement le formaldéhyde (formol, additif E 240), cancérogène certain, encore employé dans certains produits comme les vernis à ongles.
Les parabènes sont d'origine synthétique mais ils existent à l'état naturel dans certains aliments (fruits, légumes) et compléments alimentaires (propolis, gelée royale, Ylang-Ylang).
6 esters sont utilisés : le methylparabène (E218,219), l'ethylparabène (E214,215), le propylparabène (E216,217), l'isopropylparabène, le butylparabène et l'isobutylparabène. Leur structure cyclique étant commune, les propriétés diffèrent par la longueur et la conformation de la chaîne alkyle. Les méthyl et ethylparabènes, à chaîne alkyle courte, sont les moins antimicrobiens, mais les plus intéressants car solubles dans l'eau (milieu le plus sensible au risque de contaminations). Tous sont stables à la cuisson et présentent des points d'ébullition supérieurs à 270°C. Le phénoxyéthanol (allergisant certain) est souvent utilisé comme solvant de ces parabènes.
On trouve le methylparabène et l'éthylparabène dans de nombreux produits alimentaires jusqu'à 0,1% dans les boissons sucrées, crèmes, pâtes, conserves, olives. La dose journalière acceptable est de 0 à 10 mg/kg/jour. Les 6 parabènes sont à l'heure actuelle autorisés en cosmétique jusqu'à une concentration totale de 0,8%, la concentration maximale de chaque ester étant fixée à 0,4%.
Les parabènes ingérés sont tous absorbés, rapidement métabolisés et excrétés par voie urinaire, sans effet d'accumulation dans l'organisme. Appliqués sur la peau, ils passent facilement la barrière transcutanée, notamment ceux à grande chaîne alkyle, les plus lipophiles. Leur métabolisme est plus sujet à controverse.
Les parabènes sont peu irritants, même sur les muqueuses.
Le lien de causalité entre leur utilisation et le cancer du sein n'est pas établi (Darbre et al., 2004) mais du fait de leur structure, les parabènes ont une activité estrogénique. Si leur fixation sur les récepteurs estrogéniques est faible, ils augmentent en revanche les taux d'estrogènes par inhibition des sulfotransférases de la peau, ce qui peut constituer un risque.
Les parabènes, notamment les plus lipophiles, sont donc des perturbateurs endocriniens lorsqu'ils sont utilisés de façon répétée. Une évaluation du risque sur la fertilité masculine du propylparabène est en cours (rapport en novembre 2011).
En attendant et par principe de précaution, les produits évitables et contenant des parabènes ne devraient plus être appliqués sur la peau des enfants.
Nous sommes à votre disposition pour tout complément d'information.
Les parabènes (paraoxybenzoates) sont des esters d'acide p-hydroxybenzoïque.
Ils sont utilisés comme conservateurs dans l'alimentation, dans les cosmétiques et les médicaments (349 spécialités, source Clickadoc de mai 2011). Historiquement, ils ont remplacé avantageusement le formaldéhyde (formol, additif E 240), cancérogène certain, encore employé dans certains produits comme les vernis à ongles.
Les parabènes sont d'origine synthétique mais ils existent à l'état naturel dans certains aliments (fruits, légumes) et compléments alimentaires (propolis, gelée royale, Ylang-Ylang).
6 esters sont utilisés : le methylparabène (E218,219), l'ethylparabène (E214,215), le propylparabène (E216,217), l'isopropylparabène, le butylparabène et l'isobutylparabène. Leur structure cyclique étant commune, les propriétés diffèrent par la longueur et la conformation de la chaîne alkyle. Les méthyl et ethylparabènes, à chaîne alkyle courte, sont les moins antimicrobiens, mais les plus intéressants car solubles dans l'eau (milieu le plus sensible au risque de contaminations). Tous sont stables à la cuisson et présentent des points d'ébullition supérieurs à 270°C. Le phénoxyéthanol (allergisant certain) est souvent utilisé comme solvant de ces parabènes.

On trouve le methylparabène et l'éthylparabène dans de nombreux produits alimentaires jusqu'à 0,1% dans les boissons sucrées, crèmes, pâtes, conserves, olives. La dose journalière acceptable est de 0 à 10 mg/kg/jour. Les 6 parabènes sont à l'heure actuelle autorisés en cosmétique jusqu'à une concentration totale de 0,8%, la concentration maximale de chaque ester étant fixée à 0,4%.
Les parabènes ingérés sont tous absorbés, rapidement métabolisés et excrétés par voie urinaire, sans effet d'accumulation dans l'organisme. Appliqués sur la peau, ils passent facilement la barrière transcutanée, notamment ceux à grande chaîne alkyle, les plus lipophiles. Leur métabolisme est plus sujet à controverse.
Les parabènes sont peu irritants, même sur les muqueuses.
Le lien de causalité entre leur utilisation et le cancer du sein n'est pas établi (Darbre et al., 2004) mais du fait de leur structure, les parabènes ont une activité estrogénique. Si leur fixation sur les récepteurs estrogéniques est faible, ils augmentent en revanche les taux d'estrogènes par inhibition des sulfotransférases de la peau, ce qui peut constituer un risque.
Les parabènes, notamment les plus lipophiles, sont donc des perturbateurs endocriniens lorsqu'ils sont utilisés de façon répétée. Une évaluation du risque sur la fertilité masculine du propylparabène est en cours (rapport en novembre 2011).
En attendant et par principe de précaution, les produits évitables et contenant des parabènes ne devraient plus être appliqués sur la peau des enfants.
Nous sommes à votre disposition pour tout complément d'information.
Pharmacide
16/05/11 17:52
Plus de 50% des médicaments vendus sur internet sont faux.
Les faux médicaments menacent tous les pays.
Ils peuvent être au pire des mélanges contenant des substances toxiques, au mieux des préparations inefficaces.
Ces faux médicaments peuvent causer des échecs thérapeutiques, des effets secondaires néfastes, voire la mort.
Liens officiels :
France diplomatie, Fondation Chirac, Latitude France
Les faux médicaments menacent tous les pays.
Ils peuvent être au pire des mélanges contenant des substances toxiques, au mieux des préparations inefficaces.
Ces faux médicaments peuvent causer des échecs thérapeutiques, des effets secondaires néfastes, voire la mort.
Liens officiels :
France diplomatie, Fondation Chirac, Latitude France
Liste des médicaments sous surveillance
24/03/11 08:11
[maj de la liste à la date du 24/03/2011]
La liste est disponible : 77 médicaments et 12 familles.
Celle-ci sera réactualisée régulièrement.
En tant que professionnel de santé, elle n'apprend rien de nouveau sur les médicaments et familles faisant l'objet d'un suivi particulier.
Elle a le mérite de présenter une vision synthétique des enquêtes en cours, d'être disponible pour tous et de prouver que le MEDIATOR a été un accident isolé dans le travail de l'Afssaps.
Liste des médicament sous surveillance à télécharger (24/03/2011)
Je rappelle que 8000 médicaments sont disponibles en pharmacie de ville.
Tous sont potentiellement des poisons selon l'âge du patient, les pathologies associées, les doses ingérées par unités de prise ou sur 24 h, les autres traitements en cours et même l'association avec certains aliments.
Banaliser ces produits est dangereux.
Les centaines de millions d'euros dépensées en publicités revendicatives par M. Leclerc sont particulièrement inopportunes.
Il serait plus judicieux de tenter de contenir la flambée des prix des produits déjà commercialisés dans ses rayons.

La liste est disponible : 77 médicaments et 12 familles.
Celle-ci sera réactualisée régulièrement.
En tant que professionnel de santé, elle n'apprend rien de nouveau sur les médicaments et familles faisant l'objet d'un suivi particulier.
Elle a le mérite de présenter une vision synthétique des enquêtes en cours, d'être disponible pour tous et de prouver que le MEDIATOR a été un accident isolé dans le travail de l'Afssaps.
Liste des médicament sous surveillance à télécharger (24/03/2011)
Je rappelle que 8000 médicaments sont disponibles en pharmacie de ville.
Tous sont potentiellement des poisons selon l'âge du patient, les pathologies associées, les doses ingérées par unités de prise ou sur 24 h, les autres traitements en cours et même l'association avec certains aliments.
Banaliser ces produits est dangereux.
Les centaines de millions d'euros dépensées en publicités revendicatives par M. Leclerc sont particulièrement inopportunes.
Il serait plus judicieux de tenter de contenir la flambée des prix des produits déjà commercialisés dans ses rayons.

Les médicaments à risques ?
20/01/11 21:08
J'ai été abasourdi de lire et entendre dans les informations destinées au grand public que 59 médicaments étaient "à risques".
Ces médicaments font l'objet d'un plan de gestion à risque parce qu'ils ont tous été commercialisés depuis 2005.
Ce plan est une obligation pour chaque laboratoire et dans chaque pays de l'union européenne d'aller au delà de la pharmacovigilance habituelle.
Il s'agit d'un suivi adapté, visant à cibler et quantifier au plus vite certains effets indésirables ou certaines contre-indications.
Ce suivi est systématique pour tout nouveau médicament. Il est public et disponible sur le site de l'Afssaps.
Ce suivi permet d'interdire plus rapidement les nouveaux médicaments dont le rapport bénéfice/risque se révèle décevant après commercialisation.
Tous les acteurs de santé s'activent pour renforcer la surveillance de ces nouveaux médicaments.
Est-ce que cela doit être interdit pour rassurer nos journalistes ?
Ces médicaments font l'objet d'un plan de gestion à risque parce qu'ils ont tous été commercialisés depuis 2005.
Ce plan est une obligation pour chaque laboratoire et dans chaque pays de l'union européenne d'aller au delà de la pharmacovigilance habituelle.
Il s'agit d'un suivi adapté, visant à cibler et quantifier au plus vite certains effets indésirables ou certaines contre-indications.
Ce suivi est systématique pour tout nouveau médicament. Il est public et disponible sur le site de l'Afssaps.
Ce suivi permet d'interdire plus rapidement les nouveaux médicaments dont le rapport bénéfice/risque se révèle décevant après commercialisation.
Tous les acteurs de santé s'activent pour renforcer la surveillance de ces nouveaux médicaments.
Est-ce que cela doit être interdit pour rassurer nos journalistes ?
Confusion de pipettes
01/12/10 14:28
La multiplication des références et des canaux de distribution des pipettes conduisent chaque année à des centaines d'appels aux centres anti-poisons. Il n'existe en effet aucun code couleur pour différencier leur utilisation.
L'utilisation des pipettes de chlorhexidine, antiseptique, pour un lavage ophtalmique ou nasal est l'erreur la plus grave. Elle peut entraîner une hospitalisation.
L'Afssaps a rapporté récemment une hospitalisation d'urgence (convulsions d'un nourrisson de 2 mois suite à un lavage de nez avec une solution de chlorhexidine) et recommande la plus grande vigilance.
Les lavages sont toujours préconisés par l'Afssaps lors des rhinites.
Mais avant tout lavage ophtalmique ou nasal, il convient de vérifier systématiquement la nature de la solution utilisée et sa date de péremption.
L'utilisation des pipettes de chlorhexidine, antiseptique, pour un lavage ophtalmique ou nasal est l'erreur la plus grave. Elle peut entraîner une hospitalisation.
L'Afssaps a rapporté récemment une hospitalisation d'urgence (convulsions d'un nourrisson de 2 mois suite à un lavage de nez avec une solution de chlorhexidine) et recommande la plus grande vigilance.
Les lavages sont toujours préconisés par l'Afssaps lors des rhinites.
Mais avant tout lavage ophtalmique ou nasal, il convient de vérifier systématiquement la nature de la solution utilisée et sa date de péremption.

Mediator (suite)
17/11/10 07:40
La spécialité MEDIATOR (benfluorex) a été retirée du marché en novembre 2009.
Les recommandations relayées sur ce blog étaient d'arrêter immédiatement le traitement et d'en parler à son médecin lors de la prochaine consultation. L'objectif était d'envisager si nécessaire un autre traitement et de dépister une éventuelle atteinte des valves cardiaques.
L'Afssaps précise depuis le 16 novembre 2010 que tous les patients traités pendant au moins 3 mois entre le 1er janvier 2006 et le 30 novembre 2009 doivent consulter leur médecin traitant pour cet examen clinique.
Les recommandations relayées sur ce blog étaient d'arrêter immédiatement le traitement et d'en parler à son médecin lors de la prochaine consultation. L'objectif était d'envisager si nécessaire un autre traitement et de dépister une éventuelle atteinte des valves cardiaques.
L'Afssaps précise depuis le 16 novembre 2010 que tous les patients traités pendant au moins 3 mois entre le 1er janvier 2006 et le 30 novembre 2009 doivent consulter leur médecin traitant pour cet examen clinique.
Suspension d'AMM pour AVANDIA et AVANDAMET
24/09/10 07:46
Deux études diligentées par l'EMA ont prouvé une augmentation des risques cardiovasculaires sous rosiglitazone.
Le rapport bénéficie/risque de la molécule est devenu défavorable.
L'autorisation de mise sur le marché des médicaments AVANDIA et AVANDAMET est suspendue dans l'attente de nouvelles données du laboratoire GlaxoSmithKline.
Recommandations :
- ne pas interrompre brutalement votre traitement
- envisager avec son médecin un autre traitement lors de la prochaine consultation
Les médicaments AVANDIA et AVANDAMET ne seront retirés que lorsque tous nos patients auront consulté. Il n'existe pas d'équivalent thérapeutique proposé par l'Afssaps. Les modifications de traitement antidiabétique doivent donc être évaluées au cas par cas.
Le rapport bénéficie/risque de la molécule est devenu défavorable.
L'autorisation de mise sur le marché des médicaments AVANDIA et AVANDAMET est suspendue dans l'attente de nouvelles données du laboratoire GlaxoSmithKline.
Recommandations :
- ne pas interrompre brutalement votre traitement
- envisager avec son médecin un autre traitement lors de la prochaine consultation
Les médicaments AVANDIA et AVANDAMET ne seront retirés que lorsque tous nos patients auront consulté. Il n'existe pas d'équivalent thérapeutique proposé par l'Afssaps. Les modifications de traitement antidiabétique doivent donc être évaluées au cas par cas.
Calendrier vaccinal 2010
30/04/10 07:38
Remerciements à Antibiolor pour leurs soirées de formation dans le cadre de la semaine européenne de la vaccination. Le calendrier vaccinal simplifié est désormais le suivant (cliquez sur le calendrier pour l'agrandir) :


Recommandation de l'EMA de retrait de PARFENAC
25/04/10 21:25
PARFENAC est une crème anti-inflammatoire commercialisée depuis 1974 et indiquée dans le traitement symptomatique du prurit.
Depuis 1990, de nombreux effets indésirables ont été signalés, notamment des eczémas de contact parfois graves.
En 1997, le bufexamac a perdu plusieurs indications thérapeutiques (notamment le traitement des dermatites atopiques et des brûlures). Depuis 2002, nous ne pouvons le délivrer que sur ordonnance (liste II).
Le rapport bénéfice/risque vient d'être jugé défavorable par les autorités de santé allemandes et une procédure européenne est donc lancée.
L'Afssaps recommande la suspension immédiate de tous les traitements en cours.
Depuis 1990, de nombreux effets indésirables ont été signalés, notamment des eczémas de contact parfois graves.
En 1997, le bufexamac a perdu plusieurs indications thérapeutiques (notamment le traitement des dermatites atopiques et des brûlures). Depuis 2002, nous ne pouvons le délivrer que sur ordonnance (liste II).
Le rapport bénéfice/risque vient d'être jugé défavorable par les autorités de santé allemandes et une procédure européenne est donc lancée.
L'Afssaps recommande la suspension immédiate de tous les traitements en cours.
Contre-indication des mucolytiques (ou fluidifiants) chez les nourrissons
25/04/10 20:44
La commission nationale de pharmacovigilance a décidé d'interdire les mucolytiques chez les nourrissons en raison de notifications de cas d'encombrements respiratoires et d'aggravations de bronchiolite.
Tous les médicaments contenant carbocistéine et acétylcystéine (dans cette indication) sont concernés de même que FLUISEDAL SANS PROMETHAZINE, VISCOTIOL et OZOTHINE.
Le sirop HELICIDINE est également contre-indiqué chez les enfants de moins de 2 ans. Ce médicament n'est pas un mucolytique mais son principe actif est une mucoglycoproteine.
Nous rappelons que TOPLEXIL, indiqué cette fois dans les toux sèches, avait été interdit chez les nourrissons en octobre 2009.
La physiologie du nourrisson est très particulière et sa toux nécessite la plus grande prudence.
Demandez-nous conseil avant toute automédication.
Tous les médicaments contenant carbocistéine et acétylcystéine (dans cette indication) sont concernés de même que FLUISEDAL SANS PROMETHAZINE, VISCOTIOL et OZOTHINE.
Le sirop HELICIDINE est également contre-indiqué chez les enfants de moins de 2 ans. Ce médicament n'est pas un mucolytique mais son principe actif est une mucoglycoproteine.
Nous rappelons que TOPLEXIL, indiqué cette fois dans les toux sèches, avait été interdit chez les nourrissons en octobre 2009.
La physiologie du nourrisson est très particulière et sa toux nécessite la plus grande prudence.
Demandez-nous conseil avant toute automédication.
Suspension d'AMM de la sibutramine (SIBUTRAL©)
22/01/10 08:36
Le SIBUTRAL est commercialisé en France depuis 2001.
Ce médicament est indiqué chez certains patients présentant une surcharge pondérale à risque.
L'analyse des résultats de l'étude SCOUT (Sibutramine Cardiovasculaire OUTcomes trial) portant sur 9805 patients confirme les résultats préliminaires annoncés le 18 décembre 2009 (risque de complications cardiovasculaires avéré pour une perte de poids jugée modeste). Le rapport bénéfice/risque est jugé en conséquence défavorable.
Les patients actuellement sous traitement doivent envisager une autre prise en charge de leur surpoids ou obésité avec leur médecin traitant.
L'Afssaps "recommande très fortement de ne pas acheter de médicaments vendus illégalement en dehors des pharmacies (par exemple sur internet) compte tenu des risques de santé auxquels sont exposés ceux qui les acquièrent. Cette recommandation s’applique tout particulièrement aux produits pouvant contenir de la sibutramine."
Ce médicament est indiqué chez certains patients présentant une surcharge pondérale à risque.
L'analyse des résultats de l'étude SCOUT (Sibutramine Cardiovasculaire OUTcomes trial) portant sur 9805 patients confirme les résultats préliminaires annoncés le 18 décembre 2009 (risque de complications cardiovasculaires avéré pour une perte de poids jugée modeste). Le rapport bénéfice/risque est jugé en conséquence défavorable.
Les patients actuellement sous traitement doivent envisager une autre prise en charge de leur surpoids ou obésité avec leur médecin traitant.
L'Afssaps "recommande très fortement de ne pas acheter de médicaments vendus illégalement en dehors des pharmacies (par exemple sur internet) compte tenu des risques de santé auxquels sont exposés ceux qui les acquièrent. Cette recommandation s’applique tout particulièrement aux produits pouvant contenir de la sibutramine."
Suspension d'AMM des gels de kétoprofène
12/01/10 08:24
Le kétoprofène est un anti-inflammatoire.
Il a été beaucoup prescrit sous forme de gel depuis plus de 15 ans en rhumatologie et en traumatologie bénigne.
Le rapport bénéfice/risque, constamment réévalué depuis l'apparition de photoallergies, a été jugé défavorable par l'Afssaps le 18 décembre 2009.
Les dernières études montrent en effet un risque d'allergie croisée à l'octocrylène, filtre solaire largement utilisé dans les produits d'hygiène et les cosmétiques.
Les spécialités contant du gel de kétoprofène sont donc retirées du marché à l'exception de KETUM©, le laboratoire Menarini ayant déposé une requête en référé-suspension.
Nous rappelons les conseils de l'Afssaps :
Tous les traitements en cours doivent être interrompus rapidement puisque des alternatives thérapeutiques existent.
[maj 09/2010]
La suspension d'AMM est annulée.
En conséquence, tous les gels de kétoprofène sont à nouveau disponibles. Les risques d'allergie sont néanmoins réels et nous invitons les patients à la plus grande prudence lors de l'utilisation de ces gels.
Il a été beaucoup prescrit sous forme de gel depuis plus de 15 ans en rhumatologie et en traumatologie bénigne.
Le rapport bénéfice/risque, constamment réévalué depuis l'apparition de photoallergies, a été jugé défavorable par l'Afssaps le 18 décembre 2009.
Les dernières études montrent en effet un risque d'allergie croisée à l'octocrylène, filtre solaire largement utilisé dans les produits d'hygiène et les cosmétiques.
Les spécialités contant du gel de kétoprofène sont donc retirées du marché à l'exception de KETUM©, le laboratoire Menarini ayant déposé une requête en référé-suspension.
Nous rappelons les conseils de l'Afssaps :
Tous les traitements en cours doivent être interrompus rapidement puisque des alternatives thérapeutiques existent.
[maj 09/2010]
La suspension d'AMM est annulée.
En conséquence, tous les gels de kétoprofène sont à nouveau disponibles. Les risques d'allergie sont néanmoins réels et nous invitons les patients à la plus grande prudence lors de l'utilisation de ces gels.
Retrait du médicament MEDIATOR©
26/11/09 21:11
L’Afssaps suspend l’autorisation de mise sur le marché des médicaments contenant du benfluorex :
Tous les patients en cours de traitement doivent immédiatement interrompre celui-ci.
Un autre médicament sera éventuellement prescrit par le médecin traitant lors de la prochaine consultation qui n'a pas de caractère urgent.
Tous les patients ayant été exposé au benfluorex par le passé devront le rappeler à leur médecin traitant lors de la prochaine consultation.
- Mediator®
- Benfluorex Mylan®
- Benfluorex Qualimed®
Tous les patients en cours de traitement doivent immédiatement interrompre celui-ci.
Un autre médicament sera éventuellement prescrit par le médecin traitant lors de la prochaine consultation qui n'a pas de caractère urgent.
Tous les patients ayant été exposé au benfluorex par le passé devront le rappeler à leur médecin traitant lors de la prochaine consultation.
Lantus en réévaluation [maj 08/09]
30/06/09 07:23
L'Agence Européenne des Médicaments (Emea) mène dès à présent une évaluation approfondie du profil de risque de LANTUS.
L'AFSSAPS met en garde tous les patients qui interrompraient inopportunément et sans avis médical leurs traitements.
Lorsqu'une manipulation est suspectée, il faut revenir aux faits.
Le Professeur Ralph DeFronzo est à l'origine "des révélations". Il est diabétologue, chercheur à l'Université du Texas et a comparé les efficacités de BYETTA et LANTUS.
Ce professeur est membre du conseil d'administration d'Amylin et son étude a été financée par Lilly. Ce sont les deux laboratoires qui commercialisent BYETTA.
Lorsqu'un médicament est dangereux, il convient de prévenir la communauté scientifique, pas les analystes financiers ou les investisseurs.
Les conclusions telles que "tremblement de terre", "Les médecins seront gênés de prescrire LANTUS" ou "Je ne peux rien dire" sont clairement un effet d'annonce.
L'EASD (Association Européenne d'Etudes sur le Diabète) a publié 4 analyses statistiques rétrospectives de patients diabétiques. 2 d'entre elles montrent une élévation de fréquence de cancer du sein chez les patientes sous LANTUS, la 3ème une élévation de fréquence de cancer sous toutes les insulines, la 4ème ne montre au contraire aucune élévation des risques de cancer (sein, colon, pancréas et prostate).
Les professeurs Edwin Gale (rédacteur en chef de Diabelologia) et Ulf Smith (Président d'EASD) ont su montrer les limites de ces corrélations. Ils demandent des études complémentaires afin d'isoler les facteurs de risque connus et évoquent la possibilité d'aggravation de cancers préexistants.
En attendant ces études complémentaires, il paraît raisonnable de ne pas évoquer de "tremblement de terre" sauf pour l'industrie pharmaceutique qui n'a rien à gagner avec ces pratiques.
[maj 08/09]
L'Emea a conclu que ces études ne permettent pas d'établir de lien de causalité entre la prise de LANTUS et la survenue de cancer.
L'Emea et l'Afssaps confirment également qu'il n'y a pas lieu de modifier les traitements en cours.
Merci à tous nos patients sous LANTUS, puisqu'aucun d'entre eux n'a arrêté son médicament durant cette réévaluation.
L'AFSSAPS met en garde tous les patients qui interrompraient inopportunément et sans avis médical leurs traitements.
Lorsqu'une manipulation est suspectée, il faut revenir aux faits.
Le Professeur Ralph DeFronzo est à l'origine "des révélations". Il est diabétologue, chercheur à l'Université du Texas et a comparé les efficacités de BYETTA et LANTUS.
Ce professeur est membre du conseil d'administration d'Amylin et son étude a été financée par Lilly. Ce sont les deux laboratoires qui commercialisent BYETTA.
Lorsqu'un médicament est dangereux, il convient de prévenir la communauté scientifique, pas les analystes financiers ou les investisseurs.
Les conclusions telles que "tremblement de terre", "Les médecins seront gênés de prescrire LANTUS" ou "Je ne peux rien dire" sont clairement un effet d'annonce.
L'EASD (Association Européenne d'Etudes sur le Diabète) a publié 4 analyses statistiques rétrospectives de patients diabétiques. 2 d'entre elles montrent une élévation de fréquence de cancer du sein chez les patientes sous LANTUS, la 3ème une élévation de fréquence de cancer sous toutes les insulines, la 4ème ne montre au contraire aucune élévation des risques de cancer (sein, colon, pancréas et prostate).
Les professeurs Edwin Gale (rédacteur en chef de Diabelologia) et Ulf Smith (Président d'EASD) ont su montrer les limites de ces corrélations. Ils demandent des études complémentaires afin d'isoler les facteurs de risque connus et évoquent la possibilité d'aggravation de cancers préexistants.
En attendant ces études complémentaires, il paraît raisonnable de ne pas évoquer de "tremblement de terre" sauf pour l'industrie pharmaceutique qui n'a rien à gagner avec ces pratiques.
[maj 08/09]
L'Emea a conclu que ces études ne permettent pas d'établir de lien de causalité entre la prise de LANTUS et la survenue de cancer.
L'Emea et l'Afssaps confirment également qu'il n'y a pas lieu de modifier les traitements en cours.
Merci à tous nos patients sous LANTUS, puisqu'aucun d'entre eux n'a arrêté son médicament durant cette réévaluation.
Recommandations de l'EMEA concernant le dextropropoxyfène
27/06/09 22:42
L'agence européenne du médicament (EMEA) a annoncé le 25 juin qu'elle recommandait le retrait de tous les analgésiques contenant du dextropropoxyfène.
Cela concerne dans votre pharmacie les spécialités : DIANTALVIC, DIALGIREX, PROPOFAN et l'association paracetamol/dextropropoxyfène/caféine Winthrop.
Cet avis va à l'encontre de celui de l'AFSSAPS qui estimait qu'une restriction des indications était plus indiquée.
La France bénéficie en effet de conditions de dispensation beaucoup plus sûres que dans d'autres pays de la communauté. Les intoxications accidentelles ou volontaires sont donc plus rares.
Mais dans le cadre de l'harmonisation européenne du statut des médicaments contenant du dextropropoxyfène, la décision de la commission européenne s'imposera à tous les états membres.
L'EMEA recommande un retrait progressif. L'AFFSAPS propose une période transitoire d'un an après décision de la commission, temps suffisant pour trouver une alternative thérapeutique adaptée à chaque patient sans interruption des traitements antalgiques en cours.
Dans l'immédiat :
- n'utilisez ces médicaments que s'ils vous ont été prescrits personnellement
- ne dépassez en aucun cas les doses prescrites
- ne consommez ni alcool, sédatif, tranquillisant ou paracétamol pendant ces traitements
- n'hésitez pas à nous demander tout éclaircissement
Cela concerne dans votre pharmacie les spécialités : DIANTALVIC, DIALGIREX, PROPOFAN et l'association paracetamol/dextropropoxyfène/caféine Winthrop.
Cet avis va à l'encontre de celui de l'AFSSAPS qui estimait qu'une restriction des indications était plus indiquée.
La France bénéficie en effet de conditions de dispensation beaucoup plus sûres que dans d'autres pays de la communauté. Les intoxications accidentelles ou volontaires sont donc plus rares.
Mais dans le cadre de l'harmonisation européenne du statut des médicaments contenant du dextropropoxyfène, la décision de la commission européenne s'imposera à tous les états membres.
L'EMEA recommande un retrait progressif. L'AFFSAPS propose une période transitoire d'un an après décision de la commission, temps suffisant pour trouver une alternative thérapeutique adaptée à chaque patient sans interruption des traitements antalgiques en cours.
Dans l'immédiat :
- n'utilisez ces médicaments que s'ils vous ont été prescrits personnellement
- ne dépassez en aucun cas les doses prescrites
- ne consommez ni alcool, sédatif, tranquillisant ou paracétamol pendant ces traitements
- n'hésitez pas à nous demander tout éclaircissement
Délivrance d'alli
10/05/09 15:19

Disponible depuis le 6 mai 2009, alli® est un médicament dont le principe actif est déjà connu : l'orlistat (Xenical®, AMM européenne du 29 juillet 1998). alli® est dosé à 60 mg et peut être délivré sans prescription médicale. (Xenical® à 120 mg et sur liste I)
alli® n'est pas en libre service.
alli® aide à perdre en moyenne 50% de poids supplémentaire dans le cadre d'un régime hypocalorique et pauvre en graisses, mais présente effets secondaires, contre-indications et interactions. Des précautions d'emploi sont de plus nécessaires.
L'afssaps limite en conséquence l'utilisation de ce médicament aux patients :
- majeurs
- en surpoids dangereux pour la santé (IMC ≥ 28)
- ayant fait un bilan si nécessaire avec leur médecin traitant.
Veuillez nous consulter pour toute initiation ou suivi de votre traitement.
Nous disposons d'un local de confidentialité.
Libre service
04/07/08 15:54
Le libre service est à votre disposition à proximité des comptoirs (comme l'exige la loi) sur votre droite en entrant.
Nous ne délivrerons pas ces médicaments sans vous rappeler indications, posologie et précautions d'emploi.
Nous sommes à votre disposition pour toute question et tout conseil personnalisé.
Ci-dessous les recommandations de l'afssaps sur cette nouvelle évolution de notre profession.
Nous ne délivrerons pas ces médicaments sans vous rappeler indications, posologie et précautions d'emploi.
Nous sommes à votre disposition pour toute question et tout conseil personnalisé.
Ci-dessous les recommandations de l'afssaps sur cette nouvelle évolution de notre profession.
